Aineen rakenne ja alkuaineiden jaksollinen järjestelmä
Kemia » Aineen rakenne ja alkuaineiden jaksollinen järjestelmä
Tämän osion osaamistavoite on: aineen rakenteen tuntemus ja jaksollisen järjestelmän lukemisen taito, jotta voi arvioida omassa työssä vastaan tulevien aineiden kemiallisia ominaisuuksia
Perustiedot aineen rakenteesta kuuluvat yleissivistykseen ja niiden tulisi olla tuttuja jo peruskoulusta. Jos asiat kuitenkin ovat päässeet unohtumaan, tässä on oiva paikka kerrata ne! Tässä osiossa on paljon tekstiä ja kuvia: niiden tarkoitus on auttaa sinua kertaamaan asiat ilman, että joudut kesken kaiken etsimään tietoa itse.
Kemian opintojen kannalta on tärkeää, että aineen rakenne on tuttu ja alkuaineiden jaksollista järjestelmää osaa lukea. Ilman näitä taitoja on vaikea saavuttaa riittävää ymmärrystä erilaisia työssäsi käytettäviä kemikaaleja koskien.
Aineen rakenne
Kaikki ympärillämme olevat esineet, kasvit, eläimet, vesi ja ilmakin koostuvat erilaisista aineista. Aine voi olla puhdasta ainetta tai useamman puhtaan aineen seos. Puhdas aine sisältää määritelmän mukaan vain yhdenlaisia rakenneosia: puhdas rauta koostuu rauta-atomeista, puhdas sokeri puolestaan sokerimolekyyleistä. Seoksessa on sekaisin erilaisia rakenneosia: pronssissa on sekaisin kupari- ja tina-atomeita, mehussa vesimolekyylejä ja erilaisten maku- ja väriaineiden molekyylejä.
Kaikki aine koostuu atomeista oli sitten kyseessä puhdas aine tai seos. Atomit on siis kaiken aineen perusyksikkö. Atomit itsessään koostuvat pienemmistä hiukkasista: protoneista, neutroneista ja elektroneista. Jokaisessa atomissa on keskellä ydin: ydin koostuu positiivisesti varatuista protoneista ja sähköisesti neutraaleista (eli varauksettomista) neutroneista. Ytimen ympäriltä löytyy negatiivisesti varautuneita elektroneja: elektronien ajatellaan asettuneen ydintä ympäröiville elektronikuorille, joita voi olla kaikkiaan seitsemän.
Oheiseen kuvaan on merkitty atomin osat. Jotta ymmärtäisit kuinka alkuaineiden jaksollinen järjestelmä muodostuu, on tärkeää tietää, atomin eri osien nimet, joten paina ne hyvin mieleesi.

Alkuaineiden jaksollinen järjestelmä
Kaikki atomit eivät ole samanlaisia. Se, kuinka monta protonia atomin ytimessä on, kertoo minkä alkuaineen atomi on kyseessä. Kaikki atomit, joiden ytimessä on 1 protoni, ovat vetyatomeja. Samoin kaikki atomit, joiden ytimessä on 92 protonia, ovat uraaniatomeita. Eri alkuaineita on reilusti yli sata, mutta niistä vain alle sata esiintyy luonnossa sellaisenaan. Osa alkuaineista on saatu aikaiseksi vain laboratoriossa.
Kemistin on tärkeää tietää, miten mikin atomi käyttäytyy, kun tehdään kemiallisia kokeita. Atomin käytös riippuu sen rakenteesta. Alkuaineet voidaan järjestää niiden atomien rakenteen mukaan taulukoksi, josta pystyy nopeasti näkemään, miten erilaiset alkuaineet käyttäytyvät. Tämä taulukko on nimeltään alkuaineiden jaksollinen järjestelmä.
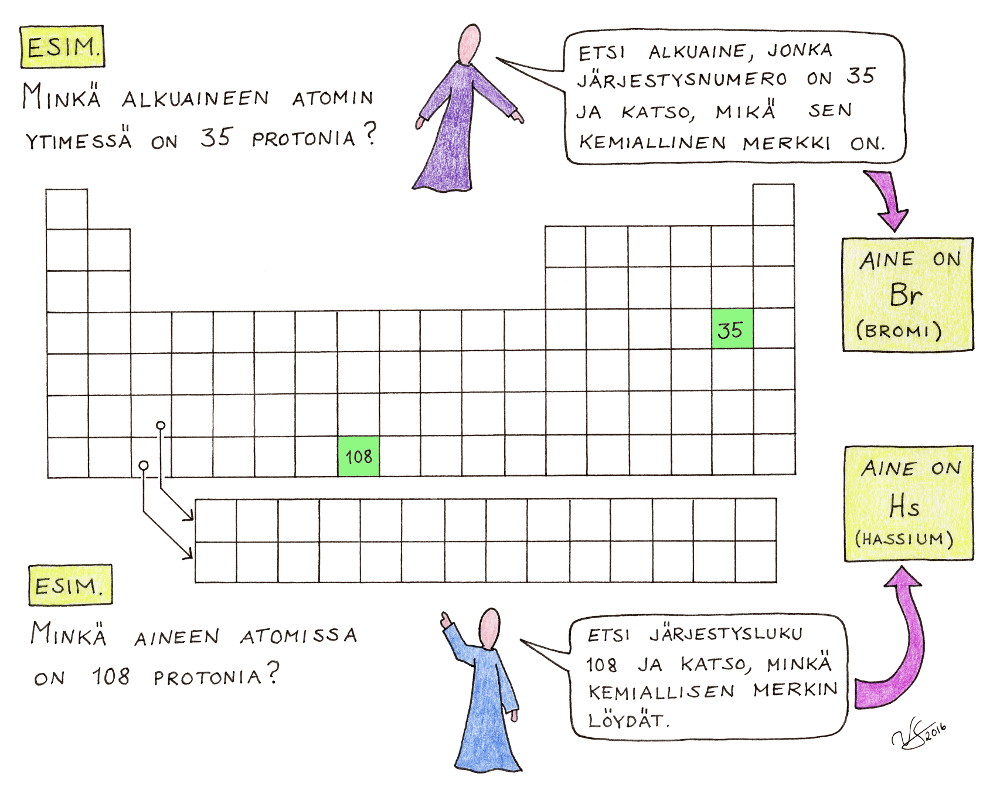
Kuinka alkuaineiden jaksollista järjestelmää luetaan? Katso oheista jaksollista järjestelmää ja etsi sieltä lukiessasi se, mistä teksti kertoo.
1) Jokaisella alkuaineella on oma yksi- tai kaksikirjaiminen tunnuksensa: kemiallinen merkki. Jos kirjaimia on vain yksi (esimerkiksi vety = H, happi = O), se on aina iso kirjain. Jos kirjaimia on kaksi, ensimmäinen on aina iso, toinen aina pieni kirjain (esimerkiksi alumiini = Al, plutonium = Pu). Muutamalla alkuaineella ei ole vielä omaa nimeä, joten niillä käytetään kolmikirjaimista väliaikaista tunnusta (joka tulee suoraan alkuaineen järjestysnumeron latinan ja kreikankielisestä nimestä).
2) Alkuaineet ovat jaksollisessa järjestelmässä järjestyksessä sen mukaan kuinka monta protonia niiden atomien ytimessä on. Protonien lukumäärä määrää alkuaineen järjestysluvun: jos siis tiedät alkuaineen järjestysluvun, tiedät heti myös sen, montako protonia sen ytimessä on. Järjestysluku on tässä jaksollisessa järjestelmässä kirjoitettu kemiallisen merkin eteen (esimerkiksi 80 Hg → elohopea-atomissa on siis 80 protonia, 17 Cl → klooriatomissa on 17 protonia).
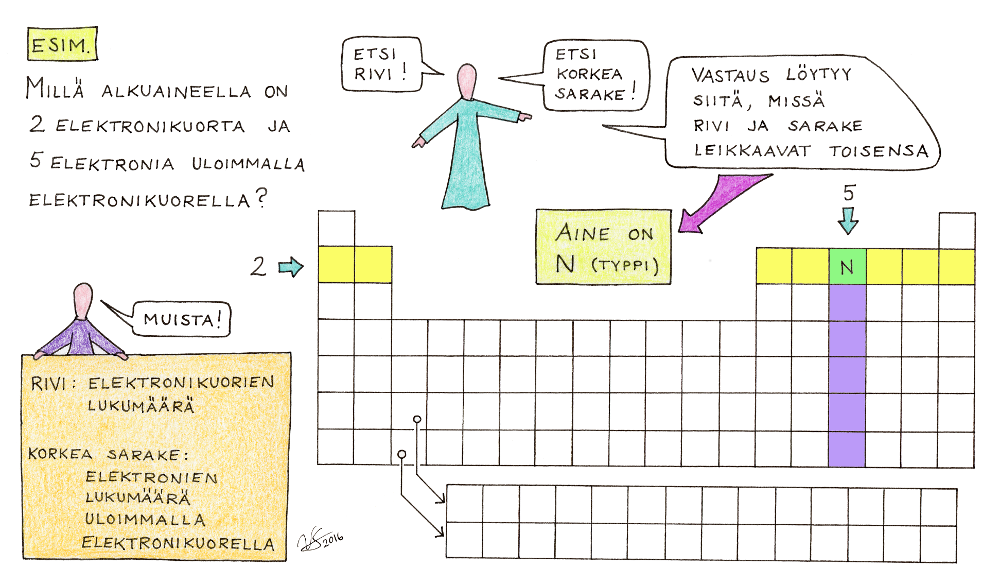
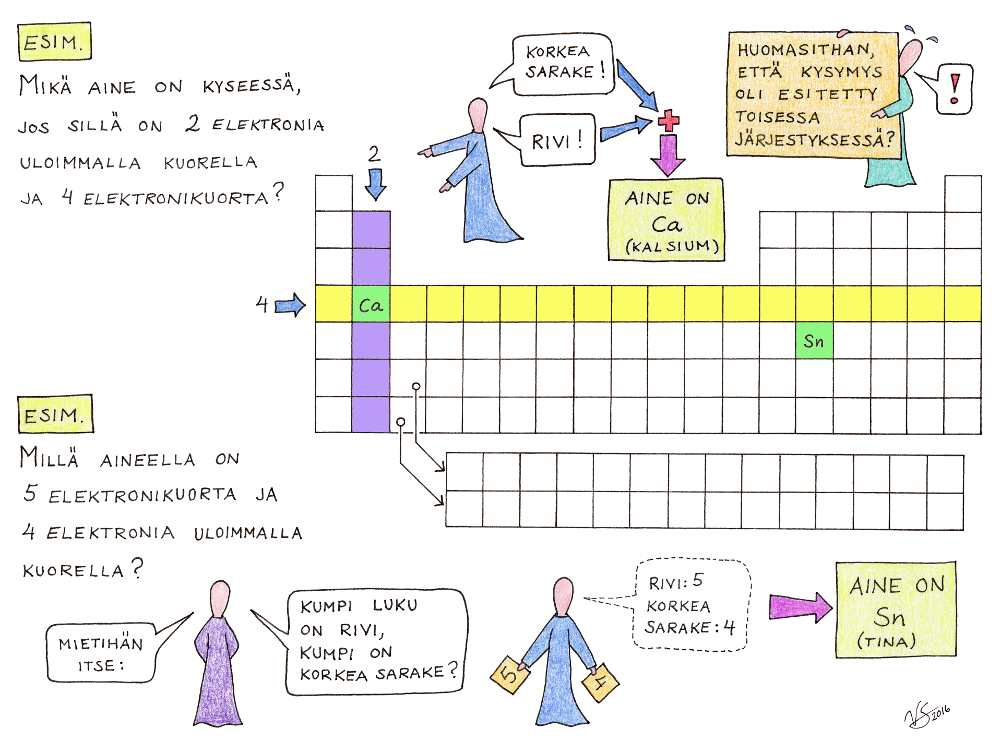
3) Alkuaineet on järjestetty taulukoon niin, että samalla rivillä olevilla alkuaineilla on yhtä monta elektronikuorta atomissaan. Rivin numero, joka on kirjoitettu rivin eteen vasemmalle, kertoo siis suoraan tuolla rivilla sijaitsevien alkuaineiden atomien elektronikuorten lukumäärän. Huomaa, että rivit jatkuvat koko taulukon ylitse: Rivillä 1 on siis kaksi ainetta, H ja He. Rivillä 2 on kahdeksan ainetta, Li, Be, B, C, N, O, F ja Ne. Samoin rivillä 3 on kahdeksan ainetta. Kun siis tiedät, millä rivillä alkuaine jaksollisessa järjestelmässä sijaitsee, tiedät heti myös sen atomien elektronikuorten lukumäärän (esimerkiksi Au on rivillä 6, joten elektronikuoria on sen atomissa kuusi kappaletta; P on rivillä 3, joten sen atomissa on kolme elektronikuorta).
4) Alkuaineen kemialliset ominaisuudet määräytyvät sen mukaan, kuinka monta elektronia sen atomin uloimmalla kuorella on. Tämäkin selviää jaksollisesta järjestelmästä. Korkeita pystysarakkeita on taulukossa kahdeksan. Se, mihin korkeaan pystysarakkeeseen alkuaine kuuluu, kertoo sen uloimman elektronikuoren elektronien lukumäärän seuraavasti: Ensimmäiseen pystysarakkeeseen (ylimpänä H) kuuluvilla on uloimmalla elektronikuorellaan 1 elektroni. Toiseen pystysarakkeeseen (ylimpänä Be) kuuluvilla on uloimmalla elektronikuorellaan 2 elektronia. Kolmanteen korkeaan pystysarakkeeseen (ylimpänä B) kuuluvilla on uloimmalla elektronikuorellaan 3 elektronia. Neljänteen korkeaan pystysarakkeeseen kuuluvilla on uloimmalla elektronikuorellaan 4 elektronia... Kahdeksanteen korkeaan pystysarakkeeseen (ylimpänä He) kuuluvilla alkuaineilla on atomissaan uloimmalla elektronikuorellaan 8 elektronia (ainoa poikkeus tästä on itse He, jolla uloimmalla kuorella on vain 2 elektronia). Kun tiedät, mihin näistä korkeista pystysarakkeista alkuaine kuuluu, tiedät heti myös sen, montako elektronia sen atomin uloimmalla elektronikuorella on (esimerkiksi Ca on toisessa korkeassa pystysarakkeessa → 2 elektronia, Cl on seitsemännessä korkeassa pystysarakkeessa → 7 elektronia). Korkeiden pystysarakkeiden väliin jääviä matalia pystysarakkeita ei tämä sääntö koske.
Tehtävä A:
Alkuaineiden jaksollista järjestelmää apunasi käyttäen selvitä mistä aineista seuraavassa on kysymys (pelkkä kemiallinen merkki riittää vastaukseksi). Tehtävän alla on avuksesi piirretyt mallit tämän tapaisten tehtävien ratkaisusta, jos tehtävät eivät pelkästään ylläolevalla ohjeistuksella onnistu.
- Aine, jonka atomissa on 25 protonia:
- Aine, jonka atomissa on 3 protonia:
- Aine, jonka atomissa on 3 elektronikuorta ja 2 elektronia uloimmalla kuorella:
- Aine, jonka atomissa on 2 elektronikuorta ja 4 elektronia uloimmalla kuorella:
Kun olet saanut ratkaistua tehtävät, tarkista tämän sivun alalaidasta, että tehtävä meni oikein!
Alkuaineiden nimet ja kemialliset merkit
Alkuaineiden kemiallisia merkkejä käytetään esimerkiksi ilmoitettaessa jonkin yhdisteen koostumus: H2O (vesi), NaCl (ruokasuola), C6H12O6 (glukoosi). Tämä on lyhyt tapa ilmoitaa, mistä atomeista yhdiste koostuu. Jos jotakin atomia on yhdisteessä monta kappaletta, se ilmoitetaan kirjoittamalla numero kyseisen atomin kemiallisen merkin perään alaindeksiksi: H2SO4 (rikkihappo) → 2 kappaletta vetyatomeja (H), yksi rikkiatomi (S) ja 4 happiatomia (O).
Kun luetaan, mistä atomeista yhdiste koostuu, on hyvin tärkeää kiinnittää huomiota siihen, ovatko kirjaimet isoja vai pieniä: Co on eri asia kuin CO (Co = koboltti, CO = hiili + happi = hiilimonoksidi eli häkä). Huomaa siis itsekin kirjoittaessasi, että alkuaineiden kemiallisissa merkeissä kirjainten koolla on väliä!
Atomien väliset sidokset
Voidakseen muodostaa yhdisteitä täytyy atomien tarttua jollakin tavalla kiinni toisiinsa. Ihan mikä tahansa atomi ei tartu kiinni ihan mihin tahansa toiseen atomiin. Yhdisteiden muodostumiseen vaikuttaa juuri atomien uloimman elektronikuoren elektronien lukumäärä, jonka voit aina tarkistaa alkuaineiden jaksollisesta järjestelmästä. Muodostaessaan sidosta toisen atomin kanssa, atomilla on tavoitteena oktetti eli kahdeksan elektronia uloimmalla elektronikuorella.
Kemiallisia sidoksia on kolmea päätyyppiä:
1) Ionisidos
Atomit voivat luovuttaa uloimpia elektronejaan tai ottaa vastaan elektroneja uloimmalle elektronikuorelleen. Kun atomi luovuttaa pois yhden negatiivisen elektronin, atomi muuttuu positiivisesti varatuksi ioniksi. Jos atomi ottaa vastaan yhden elektronin, atomista tulee negatiivisesti varautunut ioni. Ioni on siis atomi (tai useamman atomin rypäs), jolla on sähköinen varaus. Perustilassaan oleva atomi on varaukseton, koska sen elektronikuorilla on yhtä monta negatiivisesti varattua elektronia kuin sillä on positiivisesti varattuja protoneja ytimessään.
Atomin tavoite on oktetti: kahdeksan elektronia uloimmalla elektronikuorella. Atomi voi päästä tähän tavoitteeseen kahdella tavalla. Jos sen uloimmalla elektronikuorella on 1, 2 tai 3 elektronia, se voi luovuttaa ne kaikki pois, jolloin uloin elektronikuori lakkaa olemasta, ja sen alta paljastuu uusi elektronikuori, jolla on jo valmiiksi 8 elektronia. Jos atomin uloimmalla elektronikuorella on 5, 6 tai 7 elektronia, se mielellään ottaa vastaan elektroneja niin monta, että saa uloimmalle kuorelleen oktetin.
Kaksi ionia, joilla on erimerkkinen sähkövaraus (toinen on siis positiivinen ja toinen negatiivinen), vetävät toisiaan puoleensa: niiden välillä on sähköinen vuorovaikutus. Tästä vuorovaikutuksesta syntyy ionisidos kahden ionin välille. Yhdisteitä, joita pitää kasassa ionisidos, kutsutaan suoloiksi.
Ionisidokselliset aineet ovat yleensä kiteisiä ollessaan kiinteässä olomuodossa. Ne liukenevat veteen, jolloin ionisidos atomien väliltä katkeaa, ja aine hajoaa takaisin yksittäisiksi ioneiksi. Koska ionisidoksellisten yhdisteiden vesiliuos sisältää ioneja, se johtaa hyvin sähköä.
Ionisidos syntyy aina kahden ionin välille. Ioni on sähköisesti varautunut atomi tai atomien muodostama rypäs. Kuvassa on esitetty kahden erimerkkisen ionin syntyminen.
Kahdesta syntyneestä ionista voi muodostua ionisidoksellinen yhdiste eli suola, jos ne kohtaavat toisensa. Kuten kuvassa on esitetty, ionit eivät pidä toisistaan kiinni vaan pysyvät yhdessä vain sähköisen vuorovaikutuksen takia.
2) Metallisidos
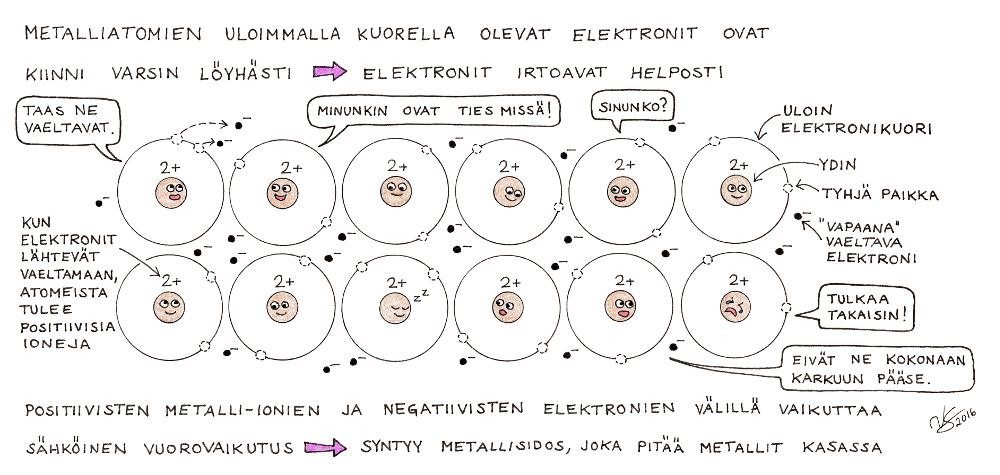
Metalleissa sidos on tätä tyyppiä. Metalliatomien uloimmalla elektronikuorella on yleensä 1 tai 2 elektronia (tätä ei suoraan näe jaksollisesta järjestelmästä, koska metallit kuuluvat niihin mataliin pystysarakkeisiin, joihin järjestelmän lukusääntö ei päde). Kiinteässä olomuodossa ollessaan metallin atomit ovat pakkautuneet säännöllisesti ja tiiviisti. Uloimman elektronikuoren elektronit ovat kuitenkin kiinni varsin löyhästi, joten ne pääsevät vaeltamaan atomilta toiselle. Metalli koostuu siis oikeastaan positiivisista metalli-ioneista ja niiden väleissä vaeltavista negatiivisista elektroneista. Kuten ionisidoksenkin tapauksessa, positiivisten metalli-ionien ja negatiivisten elektronien välillä on sähköinen vuorovaikutus. Tästä vuorovaikutuksesta syntyy metallisidos. Koska elektronit pääsevät helposti vaeltamaan metalli-ionien lomitse, metallit johtavat hyvin sähköä.
3) Kovalenttinen sidos
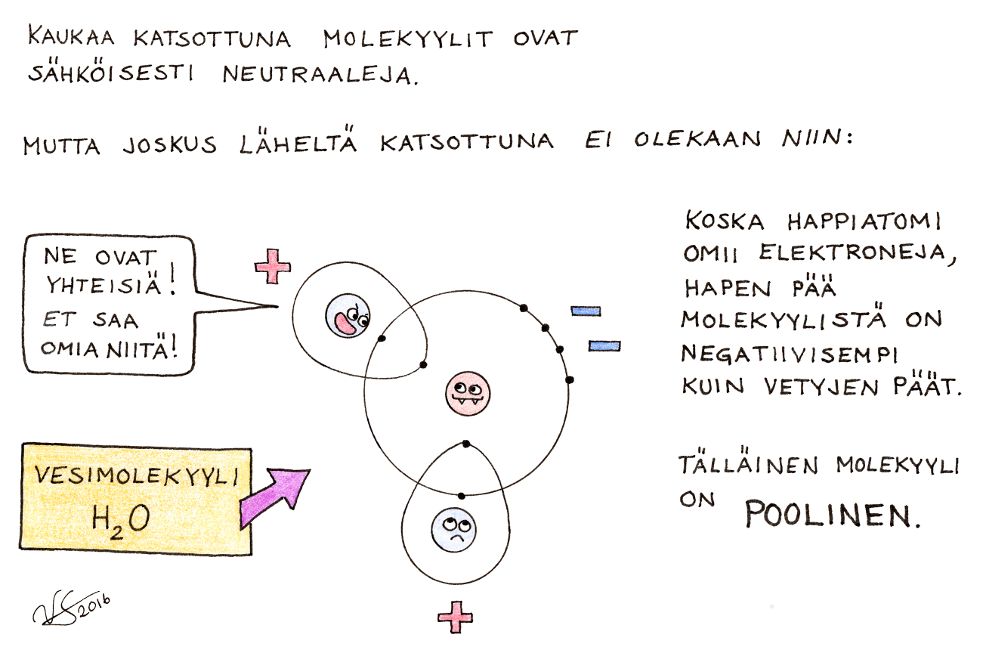
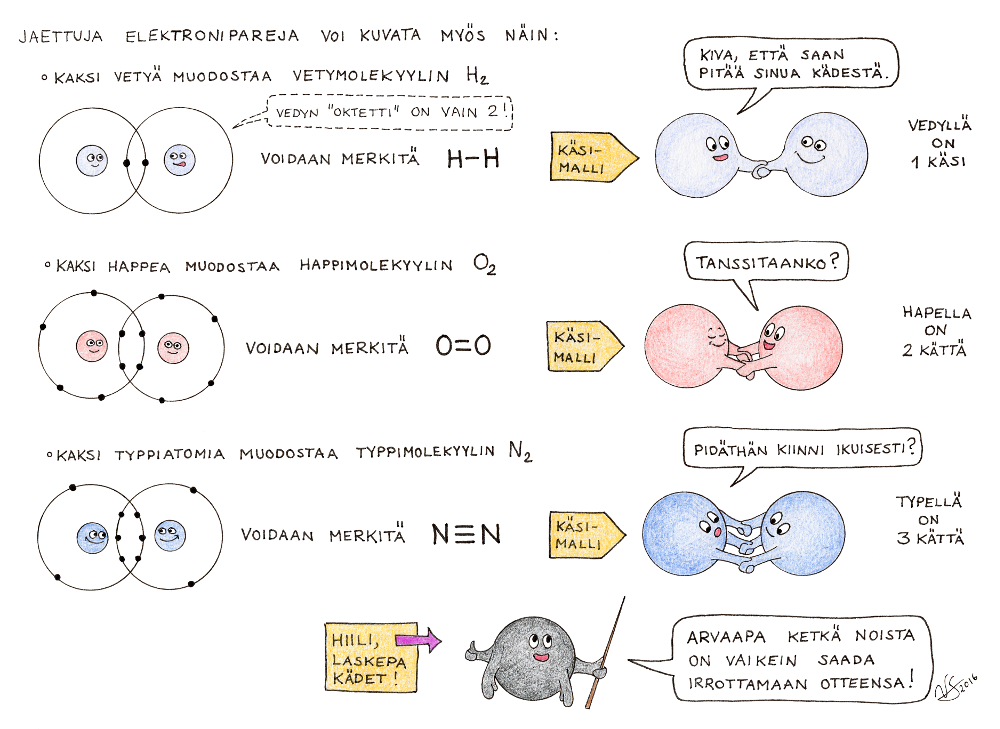
Kaikki atomit eivät noin vain luovukaan omista elektroneistaan. Jos tahtoo muodostaa yhdisteen sellaisen atomin kanssa, täytyy tyytyä jakamaan elektroneja. Esimerkiksi hiili (C), jolla on uloimmalla elektronikuorellaan 4 elektronia, ei mielellään niistä luovu, mutta se suostuu kyllä elektronien yhteisomistukseen muiden atomien kanssa. Happi (O), jolta puuttuu oktetista kaksi elektronia, esiintyy yleensä happimolekyyleinä O2: molemmat hapet ovat antaneet yhteisiksi elektroneiksi kaksi elektronia, jolloin molemmille jää neljä ihan omaa elektronia ja lisäksi on neljä yhteistä, eli molemmat happiatomit voivat kuvitella omistavansa 8 elektronia. Tällainen jaettujen elektronien välityksellä syntyvä sidos on nimeltään kovalenttinen sidos. Yhdisteitä, jotka muodostuvat kovalenttisin sidoksin, kutsutaan molekyyliyhdisteiksi.
Joillakin molekyyleillä on sisäinen varausjakauma: kun katsomme molekyyliä kaukaa, se näyttää sähköisesti täysin neutraalilta, mutta läheltä katsoessamme huomaamme, että molekyylin toinen pää on aavistuksen verran negatiinen ja toinen positiivinen. Näin on esimerkiksi vesimolekyylin (H2O) kohdalla: juuri sen takia se liuottaa suoloja niin hyvin. Molekyyli, jolla on tällainen sisäinen varausjakauma, muistuttaa kemiallisilta ominaisuuksiltaan varsin paljon ioniyhdistettä: tästä syystä ei voida vetää tarkkaa rajaa sille, onko jokin yhdiste ioni- vai molekyyliyhdiste.
Kun kemisti tahtoo kertoa hieman tarkemmin, millaisesta molekyylistä on kyse, hän kirjoittaa näkyville molekyylikaavan (jossa on pelkkiä kirjaimia ja numeroita, esim. H2O) sijasta rakennekaavan, josta näkyvät eri atomien väliset sidokset (esim. H – O – H). Yksi jaettu elektronipari muodostaa aina yhden sidoksen, jota kuvataan yksinkertaisella viivalla. Kun jaettuja elektroneja on enemmän, tulee sidosviivojakin piirtää näkyville useampia. Kuva selventää merkintätapaa.
Kertaus: mitä sinun tulee osata tehtyäsi tämän osion
- Atomin rakenne, atomin rakenneosien nimet
- Kuinka alkuaineiden jaksollista järjestelmää luetaan
- Mitä eroa on ionisidoksella, metallisidoksella ja kovalenttisella sidoksella.
Tehtävä B: Testaa oma osaamisesi:
Mene Fronteriin VerkkoKEMIAn huoneeseen ja tee siellä monivalintatesti, jotta saat tietää osaamisesi tason. Tarkemmat ohjeet testin tekemiseen on annettu testin yhteydessä.
Oikeat vastaukset tällä sivulla olleisiin tehtäviin:
Tehtävä A:
- Mn (mangaani)
- Li (litium)
- Mg (magnesium)
- C (hiili)
Päivitetty: 19.03.2016